Каковы главные основы микроразмножения комнатных растений?
![]()
Технику микроразмножения можно практиковать в домашних условиях. Многие растения можно размножить только путём микроразмножения. Так же этот метод хорош для выведения новых разновидностей растений.
Микроразмножение- это методика размножения растений в лабораторных условиях или в искусственно созданных условиях. Для микроразмножения берутся побегообразные участки растений ( кончики корней, основания молодых листьев, боковые почки) , отделяют от основного растения и помещают в питательную среду в специальный контейнер или пробирку, где они продолжают своё развитие.
У такого размножения множество положительных моментов.Особенно такой вид рекомендован для растений, зараженных вирусом. Учёными было обнаружено, что на верхушках корней образовательные ткани растения не повреждаются вирусом. Размножение растения таким способом позволяет получить абсолютно здоровое растение от зараженного.
Микроразмножение позволяет размножить те виды и разновидности растений, которые не дают семян и которые поэтому невозможно скрестить с другим видом.
Микроразмножение в домашних условиях.
Необходимые предметы.
Для него можно использовать аквариум достаточного размер. Рядом должна находится лампа дневного света ( 1000-1500 лк), дополнительная система обогрева ( температура окружающей среды должна быть 20-25 градусов), система аэрации, для которой хорошо подойдет электровентилятор.
Стерилизатор необходим для стерилизации предметов, которыми будет производиться срезка посевного материала и стерилизации субстрата и посадочных контейнеров. Дезинфицирующий отбеливатель ( гипохлорид натрия) разводится в дистиллированной воде до 5 % концентрации и используется для стерилизации рабочей поверхности, после её дезинфекции поверхность промывается дистиллированной водой. 1-2 % раствор гипохлорита натрия нужен для стерилизации микрочеренков. Все работы проводятся в медицинских перчатках.
Для срезки микрочеренков используют безопасные бритвы. Черенки складываются в специально подготовленные емкости с широким горлышком.
Субстратом для размножения обычно служит агар-агар. К агар-агару добавляют гормоны и удобрения. Готовые среды для микроразмножения можно найти в аптеках. Полученные растеньица высаживают в торфяной субстрат с нейтральной pH средой. Используют фитогормоны двух типов , для стимуляции роста и пролиферации побегов.
Начало процесса микроразмножения.
Для начала подготовить аквариум или шкаф. оснастить его освещением, отоплением, вентиляцией.
Подготовить питательную среду, обогатив её фитогормонами, наполняют этой смесью колбы или контейнеры. После этой процедуры лезвия и баночки отправляют на стерилизацию в стерилизатор, процедура стерилизации проходит в течении 20 минут при температуре 110-120 градусов. В это время идет подготовка рабочего стола, то есть его промывка 5 % раствором гипохлорита натрия.
Очередной этап- взять самую верхнюю часть растения, которая будет выращиваться (самый легкий для начинающих экземпляр для микроразмножения- сенполия), удаляют с верхушки самые мелкие листочки. Перед помещением очищенной части растения в сосуд, её дезинфицируют 2 % раствором гипохлорита натрия, и промывают дистиллированной водой. Емкость закрывают и ставят в шкаф, где она выдерживается в течении 20-40 дней, с четырнадцатичасовым освещением.
Следующий этап микроразмножения.
Когда микрочеренок, похожий на зелёный сгусток с горошину, с образовавшимися зачатками органов, подготавливают субстрат для укоренения и новые емкости, стерилизуют в стерилизаторе вместе с режущими инструментами. Рабочую поверхность простерилизовать так же, как и на первом этапе. Теперь можно достать растеньице из шкафа или закрытого аквариума, разделить его стерильным лезвием на части. Эти частички нового растения помещают в новые емкости и вновь отправляют в шкаф дней на 20-30 для образования корневой системы. Световой день так же составляет 14 часов.
Последний этап.
Когда образуются корни, растение достают из сосудов для микроразмножения и сажают в горшки , наполненный торфом с нейтральной средой. Затем эти горшочки помещают в специальные пластиковые трубы, чтобы новым растениям можно было постепенно привыкнуть к окружающей среде. После адаптации, которая длится 4-6 недель можно уже выращивать эти новые растения обычным способом, который присущ тому растению, от которого вы взяли материал для микроразмножения. Наиболее подходящие растения для микроразмножения: орхидеи, хризантемы, сенполии, бегонии, азалии, рододендроны, камелии, фикусовые и марантовые.
Клональное микроразмножение и преимущества этого метода
Клональное микроразмножение – принципиально новый метод вегетативного размножения.










Клональное микроразмножение – это принципиально новый метод вегетативного размножения – получение в условиях in vitro (в пробирке) неполовым путем растений, генетически идентичных исходному экземпляру.
Описание:
Для семенных растений характерно два способа размножения: семенной и вегетативный. Оба эти способа имеют как преимущества, так и недостатки. К недостаткам семенного размножения следует отнести, в первую очередь, генетическую пестроту получаемого посадочного материалa и длительность ювенильного периода. При вегетативном размножении сохраняется генотип материнского растения и сокращается продолжительность ювенильного периода. Однако для большинства видов (в первую очередь для древесных пород) проблема вегетативного размножения остается до конца не решенной.
Это обусловлено следующими причинами:
– не все породы, даже на ювенильной стадии, могут размножаться вегетативным способом с требуемой эффективностью (дуб, сосна, ель, орехоплодные и др.);
– практически невозможно с помощью черенкования размножать многие виды древесных пород в возрасте старше 10—15 лет;
– не всегда удается получать стандартный посадочный материал (возможность накопления и передачи инфекции);
– трудоемкостью и сложностью операций при размножении взрослых (древесных) растений с помощью прививок;
– неэффективностью разработанных технологий для получения достаточного количества генетически однородного материала в течение года.
Достижения в области культуры клеток и тканей привели к созданию принципиально нового метода вегетативного размножения — клонального микроразмножения (получение в условиях in vitro (в пробирке), неполовым путем растений, генетически идентичных исходному экземпляру). В основе метода лежит уникальная способность растительной клетки реализовывать присущую ей тотипотентность, то есть под влиянием экзогенных воздействий давать начало целому растительному организму.

В соответствии с научной терминологией клонирование подразумевает получение идентичных организмов из единичных клеток.
Клональное микроразмножение включает следующие методы:
– культивирование меристематической ткани, выделенной из апикальных и латеральных вегетативных почек растения;
– активизация уже имеющихся у микрорастений меристематических тканей путем микрочеренкования;
– индукция возникновения адвентивных почек тканями микрорастения.
Этапы клонального микроразмножения:
Процесс клонального микроразмножения можно разделить на 4 этапа:
1. Выбор растения-донора, изолирование эксплантов и получение хорошо растущей стерильной культуры.
2. Собственно микроразмножение, когда достигается получение максимального количества меристематических клонов.
3. Укоренение размноженных побегов с последующей адаптацией их к почвенным условиям, а при необходимости депонирование растений-регенерантов при пониженной температуре (+2оС, +10оС).
4. Выращивание растений в условиях теплицы и подготовка их к реализации или посадке в поле.
На каждом этапе культивирования микрорастений подбирается определенный состав питательных сред. Перед тем как вводить в культуру тот или иной вид растений, проводится его тестирование на вирусы, учитывая тот факт, что для каждого семейства и вида растений характерен свой «набор» вирусов, который влияет как на внешний вид растения, так и на его обменные процессы, фотосинтез, репродуктивность и качество урожая. На каждом этапе культивирования растений осуществляется жесткий контроль качества.
Адаптация микрорастений к нестерильным условиям, а затем их доращивание в контролируемых условиях проводится в теплицах .
Благодаря применению технологии микропрививки по авторской разработке Высоцкого В.А. выпускаются из теплицы полукарликовые сортовые саженцы, которые доращиваются в открытом грунте до пригодности к высадке в сад.
Преимущества:
– клональное микроразмножение способствует получению генетически однородного посадочного материала;
– освобождение растений от вирусов за счет использования меристемной культуры;
– высокий коэффициент размножения (10 5 – 10 6 – для травянистых, цветочных растений, 10 4 – 10 5 – для кустарниковых древесных растений и 10 4 – для хвойных);
– сокращение продолжительности селекционного процесса;
– ускорение перехода растений от ювенильной к репродуктивной фазе развития;
– размножение растений, трудно размножаемых традиционными способами;
– возможность проведения работ в течение всего года;
– возможность автоматизации процесса выращивания.
Вегетативное размножение комнатных растений 6 класс
Размножение комнатных растений: какие способы?
Комнатные растения размножают с разными целями.
Как правило домашние растения размножают для того, чтобы заменить старые на более молодые, увеличить количество экземпляров или расширить видовое разнообразие, или просто поделиться с хорошим человеком.
Наиболее часто комнатные цветы размножают вегетативно, семенами или спорами.
Мы перечислим основные способы размножения комнатных растений и дадим общую характеристику каждому из них.
Комнатные цветы в домашних условиях лучше всего размножать с марта до начала июня, а черенки герани и фуксии рекомендуют в августе-сентябре.
- Многие домашние растения размножают исключительно с помощью семян.
При размножении растений семенами, как правило, передаются видовые особенности, а сортовые признаки часто утрачиваются.
При этом семенное размножение помогает получить новый сорт растения с полезными признаками.
Вегетативное размножение позволяет получить молодое растение со всеми свойствами родительских экземпляров.
- Поэтому, комнатные растения чаще размножают вегетативно, это очень удобный, простой и довольно быстрый способ.
Способы вегетативного размножения
Чаще всего в комнатном цветоводстве используют вегетативное размножение комнатных растений, т.к. оно имеет ряд преимуществ перед семенным:
- Все полученные экземпляры будут точной копией материнского, что особенно важно при воспроизводстве сортов;
- Декоративно-лиственные виды быстрее наращивают листовую массу, а декоративно-цветущие раньше образуют цветы;
- При необходимости могут использоваться для омоложения взрослых растений, которые утратили свою декоративность.
Деление куста

Один из самых простых способов, который используют для разрастающихся вширь видов, имеющих корневище или мощные мочковатые корни (циперус, маранта, хлорофитум, сенполия, традесканция, цимбидиум, каттлея, дендробиум).
Этот способ размножения позволяет получить взрослый экземпляр, который способен быстро восстановить прежний размер. Деление куста, чаще всего, проводят во время пересадки. Каждая деленка должна иметь корни и несколько точек роста.
Черенкование

Черенкование — это укоренение различных частей растения. Размножение черенками может проводиться с помощью участков стебля, целых листьев или их частей, цветоносов.
Менее распространенные способы размножения
Комнатные растения можно размножить не только семенами или черенками, есть и другие способы.
- Листовыми черенками. Целый, здоровый, не пораженный болезнями и вредителями, лист обрезают. Помещают в почвенный субстрат или воду, оставляют до формирования корневой системы и появления дочерних росточков. Этот способ приемлем для глоксинии, кустовидной бегонии, пеперомии, фиалки.
- Отводками. Размножаются преимущественно ампельные культуры с длинными побегами, вьющиеся формы (плющ, хлорофитум). Дочерний росток, образовавшийся на длинном побеге, пригибают к емкости с грунтом, фиксируют в почвенном субстрате проволокой. Здесь достаточно быстро формируются корни. Дочернее растение отделяют, когда оно хорошо укоренится, начнет расти.
- Отпрысками. Отпрыском называют дочернее растение, формирующееся на основании материнского цветка. Его осторожно отделяют руками или обрезают, высаживают в подготовленный грунт. Важно, чтобы дочернее растение имело собственные корневые волоски. Уход за отпрысками такой же, как за черенками. Способ подходит для размножения кактусов, бромелиевых и луковичных растений (у них на материнском цветке вырастают маленькие отпрыски-луковички).
- Детками. Маленькие дочерние ростки с собственными корневыми волосками, формирующиеся на кончиках листьев, аккуратно отщипывают, высаживают в заранее подготовленный влажный субстрат. Когда растения подрастут, их пересаживают в отдельные емкости. Этот способ присущ бриофиллюму, каланхоэ, дегремоне.
- Делением куста. Многие домашние цветы (маранта, фиалка, папоротник, аспарагус, сансевиерия, калатея) разрастаются до такой степени, что образуют небольшие дочерние кусты (иначе розетки). Их проще всего размножать делением куста. Весной или в первой половине лета материнское растение извлекают из емкости, очищают от грунта. После осторожно разделяют дочернее и взрослое растение (в точке соединения их осторожно разламывают либо разрезают ножом). Каждый дочерний куст должен иметь свою точку роста, хорошо сформировавшуюся корневую систему. Дочерние кусты высаживают во влажную землю. До укоренения обеспечивают постоянное увлажнение почвы и защиту от прямого солнца.
Размножение комнатных растений может осуществляться разными способами в зависимости от особенностей конкретного вида. Но в любом случае процедура позволяет без финансовых затрат пополнить домашний цветник новыми экземплярами и провести замену взрослых растений молодыми. Главное – знать, какой метод больше всего подходит для конкретного вида, и создать оптимальные для размножения условия. Это даст возможность вырастить крепкий и здоровый, красивый комнатный цветок.
Растения из пробирок

О существовании растений из пробирок знают многие, но назвать этот способ простым и доступным сложно. Микроклонирование можно отнести к вегетативным способам размножения, но с использованием микроскопических кусочков тканей. Микроклональное размножение растений в домашних условиях возможно, но практически недоступно. Вегетативное размножение комнатных растений этим способом требует не только знаний и навыков, но и специальных питательных сред и оборудования. Тем не менее, нет ничего невозможного, и существует огромное количество успешных примеров домашних экспериментов.
Выращивание в стерильных условиях на питательных средах позволяет решить проблему прорастания семян орхидей. В таких условиях нет необходимости в симбиотических грибах, которые снабжают микроскопическое семя всем необходимым, а сеянцы хорошо заметны уже через несколько месяцев.
Любой из выбранных методов размножения позволяет получить новый экземпляр любимого комнатного растения, но хороший результат можно ожидать только при выборе оптимального способа и правильном уходе. Прежде чем приступить к размножению стоит изучить видовые особенности растения.
Стеблевые черенки и листья
Самый распространенный способ, который можно использовать круглый год. Он подходит для большинства комнатных растений.
- выберите сильный, здоровый, нецветущий побег (в длину черенок должен быть не меньше 7 см) или крепкий лист.
- обрежьте его лезвием или острым ножом: стебель – ниже узла листьев, лист – строго поперек.
- поместите в почву.
Черенки кактуса, а также крупные листья суккулентов (толстянки, очитка) нужно до посадки предварительно подсушить в течение нескольких дней, чтобы они не загнили в горшке.
Растения: фиалка, глоксиния, кактусы и другие суккуленты; бегония, традесканция, плющ, бальзамин легко дадут корни даже в стакане с водой.
Секреты успеха
- Всегда сажайте одновременно несколько черенков и не расстраивайтесь, если некоторые не приживутся.
- Почти всем черенкам (за исключением кактусов, суккулентов и герани) нужен влажный воздух, поэтому горшок с черенком лучше накрыть полиэтиленом.
- Горшок нужно держать в тени, избегайте попадания прямых солнечных лучей.
- Температура должна быть не ниже +18°С.
Популярные темы сообщений
- Интересные факты о Солнце
Солнце – это большая и единственная звезда в солнечной системе. Все планеты в нашей галактике вращаются вокруг солнца. Например, Земля совершает круг от своей орбиты и огибает солнце за 365 дней. Раньше люди считали, что не Земля вращается вокруг солнца, - Кислород
Кислород – элемент 16 группы периодической таблицы Менделеева, обозначаемый буквой O. Он входит в семейство халькогенов, к которому относят также серу селен, теллур и полоний. Слово халькоген происходит от греческого chalkos, что означает «руда». - Животные Арктики
Казалось трудно выжить в суровых климатических условиях. Особенно в тех местах, где царит вечная мерзлота, дует холодный ветер, а все берега покрыты твердыми льдами и снегами. Оказывается, многие животные привыкли к таким условиям, и такой
Воздушные отводки
Этот способ используется для переросших, потерявших декоративность растений с длинным, голым стеблем. Прикиньте, насколько вы хотели бы подкоротить стебель и в этом месте сделайте надрез, удалив кору на участке 1,5 см. (Имейте в виду, если длина отводка будет больше 60 см, он вряд ли приживется.) Этот участок стебля следует обложить сфагнумом и обмотать полиэтиленом, закрепив его на стебле с помощью проволоки в двух местах – выше и ниже надреза. Получится своеобразный висячий горшок. Через пару месяцев через полиэтилен станут видны корни. Когда это произойдет, можете смело отрезать отводок под нижней проволокой и укоренять новое растение в земле. Горшок с оставшимся «пеньком» не торопитесь выбрасывать: при регулярном поливе вы получите боковые отростки, которые затем вы сможете тоже укоренить.
Растения: драцена, фикус, монстера, диффенбахия.
Занимательная ботаника
Для особо увлеченных существуют более заковыристые методы, которые дают не менее впечатляющие результаты. Так, можно укоренить:
- часть листа: достаточно воткнуть в землю маленький треугольничек, вырезанный из листа королевской бегонии, или прямоугольник из листа сансевиерии, чтобы образовалось новое растение.
- кусочек стебля: старый сбросивший листья стебель нарезают на «колбаски» и «сажают» их в землю либо горизонтально, либо вертикально. При этом важно, чтобы на каждом кусочке стебля был хотя бы один узел. Этот способ хорош для диффенбахии и драцены.
- семена: при температуре 16–20°С вы вполне можете прорастить «крапивку»-колеус.
- споры: все поклонники папоротника могут в домашних условиях наблюдать, как под стеклом в горшке из спор появляются крохотные зеленые ростки-пластиночки.
При подготовке статьи использованы материалы книги Д.Р. Хессайона «Все о комнатных растениях».
Размножение отводками
Цветоводы не часто используют этот способ, поскольку культуры, для которых доступно применить размножение отводками отлично укореняются при помощи черенков. В зависимости от вида растения можно применить классический вариант или метод воздушной отводки.
Классическая отводка
Ее используют при работе с плющом и ампельными растениями с длинными побегами, укореняя один или одновременно несколько побегов.
Что надо сделать:
- Выберете подходящий однолетний побег.
- Наклоните выбранный побег к земле или поставьте с горшком материнского растения небольшую емкость с субстратом.
- Надрежьте по кругу кору в том месте, каким веточка будет прилегать к почве. Достаточно убрать полоску шириной в 0.5 см.
- Пригните побег к емкости с грунтом и зафиксируйте.
- Присыпьте веточку почвой и полейте.
- Поддерживайте стабильную влажность, регулярно увлажняя субстрат.

Это легко сделать при помощи скобы, шпильки или небольшого камня
Застой сокодвижения и влажность почвы спровоцируют формирование корневой системы. Когда побег вновь тронется в рост, его можно отделить от материнского экземпляра, чтобы высадить в отдельный горшок.
Обязательно обработайте места срезов древесной золой или растолченным в пыль активированным углем. Так вы убережете растения от поражения грибковыми заболеваниями.
Воздушная отводка
Метод практикуют на цветах с одресневевшим стволом. Он отлично подходит, когда у зеленого питомца слишком большая макушка, и поэтому ее нельзя использовать в качестве верхушечного черенка.
Как сделать воздушную отводку:
- Подберите подходящую веточку.
- Удалите листья в зоне укоренения, на коре сделайте надрез глубиной ⅓ от толщины веточки.
- Присыпьте разрез Корневином и активированным углем.
- Закрепите ниже точки укоренения пакет из полиэтилена, заполните его влажной смесью из нарезанного сфагнума, земли и перлита.
- Зафиксируйте полиэтилен выше точки укоренения.
- Увлажняйте субстрат отстоянной водой с помощью шприца каждые 3-4 дня.

На габаритных экземплярах можно сделать сразу по 2 воздушные отводки
Когда сквозь пленочную оболочку станут заметны развитые корни, уже самостоятельное растение остается осечь секатором от материнского цветка, и после обработки срезов активированным углем, высадить в подходящую по размеру емкость.
Микроклональное размножение растений
Микроклональное размножение растений — один из способов вегетативного размножения в условиях «in vitro»
Содержание
Общая информация
Для семенных растений характерно два способа размножения: семенной и вегетативный. Оба эти способа имеют как преимущества, так и недостатки. К недостаткам семенного размножения следует отнести, в первую очередь, генетическую пестроту получаемого посадочного материалa и длительность ювенильного периода. При вегетативном размножении сохраняется генотип материнского растения и сокращается продолжительность ювенильного периода. Однако для большинства видов (в первую очередь для древесных пород) проблема вегетативного размножения остается до конца не решенной. Это обусловлено следующими причинами:
- не все породы, даже на ювенильной стадии, могут размножаться вегетативным способом с требуемой эффективностью (дуб, сосна, ель, орехоплодные и др.);
- практически невозможно с помощью черенкования размножать многие виды древесных пород в возрасте старше 10—15 лет;
- не всегда удается получать стандартный посадочный материал (возможность накопления и передачи инфекции);
- трудоемкостью и сложностью операций при размножении взрослых (древесных) растений с помощью прививок;
- неэффективностью разработанных технологий для получения достаточного количества генетически однородного материала в течение года.
Достижения в области культуры клеток и тканей привели к созданию принципиально нового метода вегетативного размножения — клонального микроразмножения (получение в условиях in vitro (в пробирке), неполовым путем растений, генетически идентичных исходному экземпляру). В основе метода лежит уникальная способность растительной клетки реализовывать присущую ей тотипотентность, то есть под влиянием экзогенных воздействий давать начало целому растительному организму. Этот метод, несомненно, имеет ряд преимуществ перед существующими традиционными способами размножения:
- получение генетически однородного посадочного материала;
- освобождение растений от вирусов за счет использования меристемной культуры;
- высокий коэффициент размножения (105—106 — для травянистых, цветочных растений, 104—105 — для кустарниковых древесных, 104 — для хвойных);
- сокращение продолжительности селекционного процесса;
- ускорение перехода растений от ювенильной к репродуктивной фазе развития;
- размножение растений, трудно размножаемых традиционными способами;
- возможность проведения работ в течение года и экономия площадей, необходимых для выращивания посадочного материала;
Первые достижения в области клонального микроразмножения были получены в конце 50-х годов XX столетия французским ученым Жоржем Морелем, которому удалось получить первые растения-регенеранты орхидей. Успеху Ж. Мореля в микроразмножении способствовала уже разработанная к тому времени техника культивирования апикальной меристемы растений в условиях in vitro. Как правило, исследователи в качестве первичного экспланта использовали верхушечные меристемы травянистых растений: гвоздики, хризантемы, подсолнечника, гороха, кукурузы, одуванчика, салата и изучали влияние состава питательной среды на процессы регенерации и формирования растений. Ж. Морель в своих работах также использовал верхушку цимбидиума (сем. орхидные) состоящую из конуса нарастания и двух-трех листовых зачатков, из которой при определенных условиях наблюдал образование сферических сфер — протокормов. Сформировавшиеся протокормы можно было делить и затем культивировать самостоятельно на вновь приготовленной питательной среде до образования листовых примордиев и корней. В результате им было обнаружено, что этот процесс бесконечен и можно было получать в большом количестве высококачественный и генетически однородный, безвирусный посадочный материал.
В России работы по клональному микроразмножению были начаты в 60-х годах в лаборатории культуры тканей и морфогенеза Института физиологии растений им. К. А. Тимирязева РАН. Под руководством чл.-корр. РАН, академика РАСХН Бутенко Р. Г. были изучены условия микроразмножения картофеля, сахарной свеклы, гвоздики, герберы, фрезии и некоторых других растений и предложены промышленные технологии. Таким образом, первые успехи в клональном микроразмножении связаны с культивированием апикальных меристем травянистых растений на соответствующих питательных средах, обеспечивающих в конечном итоге получение растений-регенерантов.
Однако область применения микроразмножения разнообразна и имеет тенденцию к постоянному расширению. Это в первую очередь относится к размножению in vitro взрослых древесных пород, особенно хвойных, и использование техники in vitro для сохранения редких и исчезающих видов лекарственных растений. В настоящее время в этом направлении наметился положительный сдвиг.
Первые работы по культуре тканей древесных растений были опубликованы в середине 20-х годов XX столетия и связаны с именем французского ученого Готре. В них сообщалось о способности камбиальных тканей некоторых видов вяза и сосны к каллусогенезу in vitro. В последующих работах 40-х годов было выяснено о способности различных тканей вяза листового к образованию адвентивных почек. Однако дальнейший рост и формирование побегов авторами не были получены. Лишь к середине 60-х годов Матесу удалось получить первые растения-регенеранты осины, которые были доведены до почвенной культуры. Культивирование тканей хвойных город in vitro долгое время использовалось как объект исследования. Это было связано со специфическими трудностями культивирования ювенильных и тем более взрослых тканей, изолированных с растения. Известно, что древесные, и особенно хвойные, характеризуются медленным ростом, трудно укореняются, содержат большое количество вторичных соединений (фенолы, терпены и другие вещества), которые в изолированных тканях окисляются различными фенолазами. В свою очередь, продукты окисления фенолов обычно ингибируют деление и рост клеток что ведет к гибели первичного экспланта или к уменьшению способности тканей древесных пород к регенерации адвентивных почек которая с возрастом растения-донора постепенно исчезает полностью. Однако, несмотря на все трудности, ученые все чаще используют в качестве объектов исследований различные ткани и органы древесных растений В настоящее время насчитывается более 200 видов древесных растений из 40 семейств, которые были размножены in vitro (каштан, дуб, береза, клен, осина, гибриды тополей с осиной, сосна, ель, секвойя и др.), а работы в этом направлении ведутся в научных учреждениях Москвы, Санкт-Петербурга, Воронежа, Уфы, Новосибирска, Архангельска, Киева, Одессы, Ялты и др.
Этапы и методы клонального микроразмножения
Процесс клонального микроразмножения можно разделить на четыре этапа:
- выбор растения-донора, изолирование эксплантов и получение хорошо растущей стерильной культуры;
- собственно микроразмножение, когда достигается получение максимального количества мериклонов;
- укоренение размноженных побегов с последующей адаптацией их к почвенным условиям, а при необходимости депонирование растений-регенерантов при пониженной температуре (+ 2°, + 10 °C);
- выращивание растений в условиях теплицы и подготовка их к реализации или посадке в поле.
Микроразмножение – Micropropagation

Микроразмножение или культивирование тканей – это практика быстрого размножения исходного растительного материала для получения многих потомственных растений с использованием современных методов культивирования тканей растений .
Микроразмножение, также называемое культурой ткани, используется для размножения растений, таких как те, которые были генетически модифицированы или выведены с помощью обычных методов селекции растений . Он также используется для получения достаточного количества всходов для посадки от маточного растения, которое не дает семян или плохо реагирует на вегетативное размножение .
Ботаник из Корнельского университета Фредерик Кэмпион Стюард открыл и впервые применил микроразмножение и культуру тканей растений в конце 1950-х – начале 1960-х годов.
СОДЕРЖАНИЕ
- 1 ступени
- 1.1 Выбор материнского растения
- 1.2 Умножение
- 1.3 Предварительная трансплантация
- 1.4 Перенос из культуры
- 2 Методы
- 2.1 Культура меристем
- 2.2 Культура каллуса
- 2.3 Культура эмбрионов
- 2.4 Культура протопластов
- 3 преимущества
- 4 Недостатки
- 5 ссылки
- 5.1 Примечания
Вкратце, этапы микроразмножения можно разделить на 4 этапа .
- Выбор материнского растения
- Умножение
- Укоренение и акклиматизация
- Перенести новое растение в почву
Выбор материнского растения
Микроразмножение начинается с выбора растительного материала для размножения. Ткани растения удаляют с неповрежденного растения в стерильном состоянии. Чистые исходные материалы, не содержащие вирусов и грибков, важны для выращивания самых здоровых растений. После того, как растительный материал выбран для культивирования, начинается сбор эксплантата (ов), который зависит от типа ткани, которая будет использоваться; включая кончики стеблей, пыльники, лепестки, пыльцу и другие ткани растений. Затем материал эксплантата стерилизуют поверхность, обычно с помощью нескольких курсов промывки отбеливателем и спиртом, и, наконец, ополаскивают в стерилизованной воде. Эта небольшая часть растительной ткани, иногда только одна клетка, помещается в среду для выращивания , обычно содержащую сахарозу в качестве источника энергии и один или несколько регуляторов роста растений ( гормоны растений ). Обычно среду загущают агаром, чтобы создать гель, который поддерживает эксплантат во время роста. Некоторые растения легко выращивать на простых средах, но другим для успешного роста требуются более сложные среды; ткань растения растет и дифференцируется в новые ткани в зависимости от среды. Например, среды, содержащие цитокинин , используются для создания разветвленных побегов из почек растений.
Умножение
Умножение – это взятие образцов тканей, полученных на первом этапе, и увеличение их количества. После успешного внедрения и роста растительной ткани за стадией укоренения следует размножение. Посредством повторяющихся циклов этого процесса один образец эксплантата может быть увеличен с одного до сотен и тысяч растений. В зависимости от типа выращиваемой ткани размножение может включать разные методы и среды. Если выращиваемый растительный материал представляет собой каллусную ткань, его можно поместить в блендер, разрезать на более мелкие кусочки и повторно культивировать на той же культуральной среде, чтобы вырастить больше каллусной ткани. Если ткань выращивается в виде небольших растений, называемых проростками, часто добавляются гормоны, которые заставляют проростки давать много маленьких побегов. После образования множества побегов эти побеги переносят на среду для укоренения с высоким соотношением ауксин / цитокинин. После развития корней ростки можно использовать для закаливания.
Претрансплантационный

Этот этап включает обработку проростков / побегов, чтобы стимулировать рост корней и «закаливание». Это выполняется in vitro или в стерильной среде «пробирки».
«Закаливание» относится к подготовке растений к естественной среде роста. До этой стадии саженцы выращивались в «идеальных» условиях, способствующих быстрому росту. Из-за контролируемого характера их созревания проростки часто не имеют полностью функциональных кожных покровов. Это делает их очень восприимчивыми к болезням и неэффективным в использовании воды и энергии. В условиях in vitro высокая влажность, и у растений, выращенных в этих условиях, часто не образуется рабочая кутикула и устьица, которые препятствуют высыханию растения. При изъятии из культуры проросткам нужно время, чтобы приспособиться к более естественным условиям окружающей среды. Закаливание обычно включает в себя медленное отлучение проростков от теплой среды с высокой влажностью, слабым освещением и до того, что считается нормальной средой роста для рассматриваемых видов.
Перенос из культуры

На заключительной стадии микроразмножения растений проростки удаляют из растительной среды и переносят в почву или (чаще) в горшечный компост для продолжения роста обычными методами.
Этот этап часто совмещают с этапом «предтрансплантационный».
Методы
Меристем культура
В культуре меристем меристему и несколько прилегающих к ней зачатков листьев помещают в подходящую среду для выращивания. Через несколько недель появляется росток с удлиненными корнями, который переносят в почву, когда он достигает значительной высоты. Этим методом можно получить безболезненное растение. Экспериментальные результаты также предполагают, что этот метод может быть успешно использован для быстрого размножения различных растительных материалов, например сахарного тростника, клубники.
Каллусная культура
Каллус является масса недифференцированных паренхиматозных клеток. Когда живая ткань растения помещается в искусственную среду для выращивания с другими благоприятными условиями, образуется каллус. Рост каллуса зависит от гомогенных уровней ауксина и цитокинина, и им можно управлять путем эндогенного поступления этих регуляторов роста в культуральную среду. Рост каллуса и его органогенез или эмбриогенез можно разделить на три стадии.
- Этап I: быстрое образование каллуса после помещения эксплантов в питательную среду.
- Стадия II: каллус переносят в другую среду, содержащую регуляторы роста, для индукции придаточных органов.
- Стадия III: новый росток затем постепенно подвергается воздействию условий окружающей среды.
Культура эмбрионов
В культуре эмбрионов эмбрион вырезается и помещается в культуральную среду с надлежащим питательным веществом в асептических условиях. Чтобы получить быстрый и оптимальный рост всходов, его переносят в почву. Это особенно важно для получения межвидовых и межродовых гибридов и для преодоления эмбриона.
Культура протопластов
В культуре протопластов растительную клетку можно выделить с помощью ферментов, разрушающих стенки, и выращивания в подходящей культуральной среде в контролируемых условиях для регенерации проростков. В подходящих условиях протопласт развивает клеточную стенку с последующим увеличением клеточного деления и дифференцировки и вырастает в новое растение. Протопласты сначала культивируют в жидкой среде при температуре от 25 до 28 ° C с интенсивностью света от 100 до 500 люкс или в темноте, и после значительного деления клеток их переносят в твердую среду, благоприятную для морфогенеза, во многих садовых культурах хорошо реагируют на культуру протопластов. .
Преимущества
Микроразмножение имеет ряд преимуществ перед традиционными методами размножения растений:
- Основным преимуществом микроклонального размножения является получение множества растений, которые являются клонами друг друга.
- Микроразмножение можно использовать для получения свободных от болезней растений.
- Он может иметь чрезвычайно высокую плодовитость , давая тысячи отростков, в то время как традиционные методы могут дать лишь небольшую часть этого числа.
- Это единственный жизнеспособный метод регенерации генетически модифицированных клеток или клеток после слияния протопластов .
- Это полезно при размножении растений, которые дают семена в неэкономичных количествах, или когда растения стерильны и не дают жизнеспособных семян, или когда семена не могут храниться (см. Устойчивые семена ).
- Микроразмножение часто дает более устойчивые растения, что приводит к ускоренному росту по сравнению с аналогичными растениями, полученными обычными методами, такими как семена или черенки.
- Некоторые растения с очень мелкими семенами, в том числе большинство орхидей, наиболее надежно выращивают из семян в стерильной культуре.
- На квадратный метр можно получить большее количество растений, а пропагулы можно хранить дольше и на меньшей площади.
Недостатки
Микроразмножение – не всегда идеальный способ размножения растений. Условия, ограничивающие его использование, включают:
- На оплату труда может приходиться от 50% до 69% эксплуатационных расходов.
- Монокультуры производятся после того, как вегетативный, что приводит к отсутствию общей устойчивости заболевания, так как все растения потомства могут быть уязвимы для одних и тех же инфекций.
- Образец инфицированного растения может дать инфицированное потомство. Это необычно, поскольку исходные растения тщательно проверяются и проверяются, чтобы предотвратить культивирование растений, инфицированных вирусом или грибком.
- Не все растения могут быть успешно культивированы в тканях, часто потому что не известна подходящая среда для роста или растения производят вторичные метаболические химические вещества, которые задерживают или убивают эксплант.
- Иногда растения или сорта не соответствуют типу после культивирования тканей. Это часто зависит от типа материала эксплантата, используемого во время фазы инициации, или от возраста клетки или линии пропагул.
- Некоторые растения очень сложно дезинфицировать от грибковых организмов.
Основным ограничением использования микроразмножения для многих растений является стоимость производства; для многих растений использование семян, которые обычно свободны от болезней и производятся в большом количестве, позволяет легко получить растения (см. ортодоксальные семена ) в больших количествах по более низкой цене. По этой причине многие селекционеры не используют микроразмножение из-за непомерно высоких затрат. Другие селекционеры используют его для выращивания маточных растений, которые затем используются для размножения семян.
Механизация процесса могла бы снизить трудозатраты, но оказалось труднодостижимым, несмотря на активные попытки разработать технологические решения.
СПОСОБ КЛОНАЛЬНОГО МИКРОРАЗМНОЖЕНИЯ РАСТЕНИЙ Российский патент 1997 года по МПК A01H4/00
Описание патента на изобретение RU2080780C1
Изобретение относится к биотехнологии и может быть использовано для массового размножения растений в условиях культуры ткани.
Клональное микроразмножение растений это один из видов техники in vitro, используемый для быстрого неполового размножения растений. Преимуществами этого вида размножения в сравнении с традиционными методами являются значительно более высокие коэффициенты размножения, миниатюризация процесса, оздоровление посадочного материала от разного рода инфекций. В условиях in vitro можно размножать растения, которые трудно размножаются обычным способом, например древесные растения.
Области применения клонального микроразмножения разнообразны и имеют тенденцию к расширению. Наиболее широко оно используется для размножения вновь созданных и уже существующих хозяйственных сортов с целью массового получения оздоровленного посадочного материала.
Основными этапами при клональном микроразмножении растений являются получение регенерантов из эксплантов, которые выделяют из различных органов и тканей растений, и собственно размножение регенерантов, осуществляемое различными путями, например стимуляцией (развития пазушных почек экспланта, микрочеренкованием побега, индукцией) образования адвентивных почек тканями листа и стебля и другими путями.
В настоящее время для ряда сельскохозяйственных культур разработаны технологии размножения in vitro: на ячменно-ржаных и ячменно-пшеничных гибридах (Першина Л.А. Шумный В.К. “Особенности каллусной ткани и растений -регенератов ячменно-ржаных и ячменнно-пшеничных гибридов”. Культура клеток растений и биотехнология. М. Наука, 1986, с. 176-178), на перспективных сортах винограда (Дорощенко Н.Н. “Микроклональное размножение перспективных сортов винограда”. Тезисы докладов Всесоюзной научно-технической конференции “Применение биотехнологии в животноводстве, растениеводстве и ветеринарной медицине” 11-13 октября 1988 г. Л. с. 163-164) и других сельскохозяйственных культурах.
Наиболее близким способом является способ получения посадочного материала картофеля (Мелик-Саркисов О.С. Овчинникова В.Н. Ульянов Р.П. Получение безвирусного посадочного материала картофеля микроклубнями, индуцированными в культуре in vitro. Методические рекомендации. ВАСХНИЛ, ВНИИ прикладной молекулярной биологии и генетики. М. 1985), который заключается в следующем: глазки клубня картофеля, вырезанного вместе с частью паренхимы клубня, проращивают во влажном песке. Из верхушечной части выросших проростков изолируют апикальную меристему, которую помещают в пробирки на поверхность агаризованной питательной среды и культивируют в течение 60 дней до формирования в пробирках регенерантов. Пробирочные растения черенкуют. Черенки помещают на питательную среду и выращивают 3-4 недели до образования растений-регенерантов. Последние используют для получения миниклубней или в условиях in vitro, или в условиях защищенного грунта.
Культивирование эксплантов до образования регенерантов и укоренение микрочеренков осуществляют на агаризованных питательных средах. На основу сред используют среду по прописи Мурасиге и Скуга (Murashige T. Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue ciltures. Phisiol. Plant. 1962. V. 15. N13. P. 473-497), которая содержит, мг/л: макросоли: NH4NO3 1650, KNO3 1900, MgSO4 • 7H2O 370, CaCl2 • 2H2O 440, KH2PO4 170; микросоли: MnSO4 • 4H2O 22,3, H3BO3 – 6,2, ZnSO4 • 4H2O 8,6, CoCl2 • 6H2O – 0,025, CuSo4 • 5H2O 0,025, NaMoO4 • 2H2O 0,025, Kl 0,83; витамины: тиамин 0,1, миоинозитол 80, пиридоксин – 0,5, никотиновая кислота 0,5.
Источником углеродного питания служит сахароза в количестве 20000 мг/л. Для уплотнения в среду добавляют агар (7000 мг/л).
Для формирования регенерантов из эксплантов в среду добавляют гибберелловую кислоту (2,0 мг/л) и кинетин (1,0 мг/л).
На этапе укоренения микрочеренков среда содержит β -индолилуксусную кислоту или b индолилмасляную кислоту в количестве 0,05 или 0,1 мг/л соответственно.
Необходимым условием клонального микроразмножения растений является стабильное воспроизводство исходного генотипа.
Однако соблюдение этого условия вызывает ряд трудностей, т.к. биологически активные компоненты питательных сред способны вызывать генетические изменения в клетках, что приводит к генетической вариабельности получаемых регенерантов. В процессе культивирования in vitro генетические изменения накапливаются, увеличивается количество регенерантов, отличающихся от исходного типа (Леонова Н.С. “Использование метода культуры ткани в селекции картофеля”. Сибирский вестник с/х науки, 1986, N3, с. 18-26).
Такие изменения характерны и для известного способа. У растений-регенерантов отмечается большое количество нарушений хромосом, уменьшается количество клеток с нормальным кариотипом. Регенеранты характеризуются значительным морфофизиологическим разнообразием и утратой ценных хозяйственных признаков.
Таким образом, разработка приемом культивирования растений, направленных на снижение отрицательного воздействия компонентов питательных сред на клетки и на стабильное воспроизведение исходного (нормального) генотипа, является актуальной задачей.
Технический эффект от использования изобретения заключается в увеличении выхода регенерантов с исходным (нормальным) генотипом.
Технический эффект достигается с помощью способа клонального микроразмножения растений, включающего посадку экспланта на питательную среду для получения регенерантов, их микрочеренкование и укоренение микрочеренков на питательной среде, содержащей сахара в качестве источника углерода, отличающуюся тем, что в качестве источника углерода среда для укоренения содержит фруктозу в количестве 10000-20000 мг/л или смесь фруктозы и сахарозы в соотношении 0,5-1:1.
Фруктоза представляет собой моносахарид, относится к группе гексоз, сохраняет ряд особенностей, присущих карбонильной группе, и часто определяется как восстанавливающий сахар. Фруктоза легко проникает через клеточные мембраны и вступает в гликолитический путь дыхания (Калинин Ф.Л. Лобов В.П. Жидков В.А. Справочник по биохимии. Киев, Наукова Думка, 1971, с.500).
Использование ее в питательных средах для культивирования растений in vitro как отдельно, так и в смеси с сахарозой неизвестно.
Внесение в среду для укоренения фруктозы меньше 10000 мг/л не позволяет достичь необходимого результата, а выше 20000 мг/л существенным образом не изменяет достигаемый технический эффект.
Предлагаемый способ апробировали на растениях картофеля (сорт Янтарный), гибридах томатов (Союз-3, Верлиока и 855) и стахисе байкальском (Stachys baicalensis Fisch).
Эффективность предлагаемого и известного способов оценивали по количеству клеток у растений-регенерантов, имеющих нормальный (исходный) кариотип.
Растения-регенеранты сравнивали по биометрическим и цитогенетическим показателям, а также по продуктивности при высадке растений в грунт.
Цитогенетический анализ структурных и количественных изменений хромосом проводили на давленных ацетокарминовых препаратах по общепринятой методике.
Пример 1 (контроль). Для введения в культуру in vitro и получения оздоровленных регенерантов картофеля используют метод апикальной меристемы в культуре in vitro (Мелик-Саркисов О.С. Овчинникова В.Н. Ульянов Р.П. “Получение безвирусного посадочного материала картофеля микроклубнями, индуцированными в культуре in vitro”. Методические указания, М. 1985).
Глазки клубня картофеля вырезают вместе с частью паренхимы клубня (1,5 x 1,5 см) и проращивают во влажном песке при 25-27 o С в темноте. Выросшие этиолированные проростки срезают, стерилизуют в 0,1%-ном растворе диацида 5-7 мин и трижды промывают стерильной водой. Из верхушечной части побега изолируют апикальную меристему размером 150-250 мк. Изолированную меристему помещают в пробирку на поверхность агаризованной питательной среды следующего состава, мг/л: макро- и микроэлементы по Мурасиге и Скугу, сахароза 20000, агар 7000, тиамин 1,0, пиридоксин 0,5, никотиновая кислота 0,5, аскорбиновая кислота 1,0, гибберелловая кислота 2,0, кинетин 1,0.
Культивирование апексов проводят в течение 60 дней при 16-часовой продолжительности светового дня, температуре 24-25 o C днем и 19-20 o C ночью и освещенности 5000-6000 лкс.
Сформированные пробирочные растения используют для дальнейшего размножения с помощью микрочеренкования.
В стерильных условиях растений извлекают из пробирок. С помощью скальпеля растения разрезают на черенки, количество которых соответствует числу узлов на исходном пробирочном растении.
Укоренение черенков осуществляют на питательной среде (среда для укоренения) следующего состава, мг/л: макро- и микроэлементы по Мурасиге и Скугу, сахароза 20000, агар 7000, тиамин 1,0, пиридоксин 0,5, никотиновая кислота 0,5, аскорбиновая кислота 1,0.
Для ускорения добавляют b индолилмасляную кислоту или b – индолилуксусную кислоту в количестве 0,1 или 0,05 мг/л соответственно.
Культивирование черенков проводят в тех же условиях, что и апикальные меристемы. Время культивирования 3-4 недели.
Полученные растения регенеранты на среде для укоренения используют для получения микроклубней или в условиях in vitro или в закрытом грунте.
В первом случае пробирочные растения черенкуют и черенки высаживают в пробирки с питательной средой, которая содержит, мг/л: макро- и микроэлементы по Мурасиге и Скугу, сахарозу 40000-60000, агар 6000, тиамин 1,0, пиридоксин 0,5, никотиновую кислоту 0,5, аскорбиновую кислоту 1,0, кинетин 0,5.
Черенки инкубируют при 16-часовой продолжительности светового дня, температуре 24-25 o C днем и 19-20 o C ночью при освещенности 5000-6000 лкс.
После образования у пробирочных растений 5-6 листьев пробирки с растениями на 3 недели переносят в климатическую камеру с температурой 15 o C и продолжительностью светового дня 8 ч. В зависимости от сорта картофеля образование клубней происходит через 1-1,5 месяца после переноса растений в условия, индуцирующие клубнеобразование.
При получении миниклубней в защищенном грунте растения картофеля, полученные in vitro, высаживают в грунт и выращивают в заданных условиях до получения миниклубней кондиционных размеров (3-5 г).
Пример 2 (опыт). Ведение в культуру in vitro и получение регенерантов картофеля, а также их микрочеренкование, проводят согласно примеру 1. Укоренение микрочеренков осуществляют на питательной среде для укоренения, в которой в качестве источника углерода используют фруктозу в количестве 10000-20000 мг/л или смесь фруктозы и сахарозы в соотношении 0,5 1:1.
Время и условия культивирования пробирочных растений аналогичны примеру 1.
Из пробирочных растений, выросших на среде для укоренения, в условиях in vitro или в защищенном грунте получают миниклубни.
Миниклубни картофеля, полученные от растений-регенерантов, выращенных по примерам 1 и 2, высаживают в почву и наблюдают за развитием растений.
Проводят цитогенетический анализ корневых и стеблевых меристем. Развитие растений оценивают по биометрическим показателям и продуктивности.
В опыте по сравнению с контролем наблюдали более раннюю и дружную всхожесть растений (всходы появлялись на 5 дней раньше). Растения отличались однородностью, крепостью стебля и мощной, не измененной морфологически листовой поверхностью. Урожайность опытных растений значительно превышала урожайность контрольных растений.
Цитогенетический анализ показал, что количество нарушений хромосом в контроле в 1,5 2 раза больше, чем у опытных растений, а количество клеток с нормальным кариотипом (2n=48) в 1,5 1,64 раза меньше. Результаты представлены в табл. 1.
Пример 3 (контроль). Регенеранты стахиса, оздоровленные методом апикальной меристемы в условиях in vitro (см. пример 1), размножают микрочеренкованием. Для черенкования используют регенеранты с 8-10 листьями. Черенки высаживают в пробирки на питательную среду для черенкования (см. пример 1). Культивирование стахиса проводят при 16-часовой продолжительности светового дня, освещенности 5000 лкс, температуре 24 25 o C днем и 19-20 o C ночью. Через 4-5 недель культивирования выросшие пробирочные растения высаживают в грунт.
Пример 4 (опыт). Укоренение черенков стахиса проводят на среде для черенкования, в которой в качестве источника углерода используют фруктозу в количестве 10000 20000 мг/л или смесь фруктозы и сахарозы в соотношении 0,5 1:1 (см. пример 2).
Пробирочные растения стахиса, полученные по примерам 3 и 4, высаживают в открытый грунт и выращивают до окончания вегетационного периода (до полного увядания растений).
У растений проводят цитогенетический анализ корневых и стеблевых меристем. Развитие растений оценивают по биометрическим показателям и продуктивности.
Цитогенетические исследования показали, что у опытных растений в меристемах корня и стебля количество клеток с нормальным кариотипом более, чем в 3 раза больше по сравнению с контрольными растениями.
Опытные растения характеризовались многостебельностью и большей облиственностью. Общая площадь листовой поверхности в растете на один куст в 1,5 3 раза превышает таковую у контрольных растений. Урожайность клубней увеличивается в 1,5 раза.
Результаты представлены в табл.2.
Пример 5 (контроль). Для клонального микроразмножения гибридов томата используют семена этих растений.
Для введения в асептическую культуру семена в течение 5-7 мин стерилизуют в 0,1%-ном растворе диацида, трижды промывают стерильной водой. Подготовленные таким образом семена по одному помещают в пробирки с питательной средой следующего состава, мг/л: макро- и микроэлементы по Мурасиге и Скугу, сахароза 20000, агар 7000, тиамин 1,0, пиридоксин 0,5, никотиновая кислота – 0,5, аскорбиновая кислота 1,0, b индолилмасляная кислота 0,1.
Культивирование осуществляют при 24-25 o C днем и 19-20 o C ночью, 16-часовой продолжительности светового дня и освещенности 5000-6000 лкс. Время культивирования 3-4 недели. В течение этого срока формируются пробирочные растения с 4-5 листьями.
Полученные растения черенкуют и каждый черенок высаживают в пробирку на агаризованную питательную среду для черенкования. Среда, условия и время культивирования аналогичны примеру 1.
Пример 6 (опыт). Пробирочные растения томатов, полученные по примеру 5, черенкуют. Укоренение микрочеренков проводят на среде для черенкования, в которой в качестве источника углерода используют фруктозу в количестве 10000-20000 мг/л или смесь фруктозы и сахарозы в соотношении 0,5 1:1.
Время и условия культивирования по примеру 1.
Регенеранты, полученные после черенкования по примерам 5 и 6, высаживают в грунт и выращивают до полного созревания плодов.
До высадки в грунт у регенерантов проводят цитогенетический анализ корневых и стеблевых меристем.
Развитие растений оценивают по биометрическим показателям и продуктивности растений.
Анализ показал, что у опытных растений томатов клеток с нормальным кариотипом в 2 раза больше, чем у контрольных.
В условиях защищенного грунта опытные растения, развивающиеся из регенерантов, опережают в своем развитии контрольные растения.
Стадия бутонизации, начало цветения, завязывания плодов у опытных растений наступает на две недели раньше, чем у контрольных. Начало созревания плодов у опытных растений отмечается через 3 месяца после высадки в грунт, тогда как у контрольных через 3,5 месяца. В среднем, в зависимости от гибрида томатов, урожайность растений в 1,5 2,2 раза превышает урожайность контрольных растений (табл.3).
Таким образом, использование в качестве источника углерода в среде для укоренения фруктозы в количестве 10000-20000 мг/л или смеси фруктозы и сахарозы в соотношении 0,5 1:1 уменьшает структурные и количественные изменения хромосом. Число клеток с нормальным кариотипом возрастает. Растения-регенеранты, полученные по предлагаемому способу, в условиях защищенного грунта опережают в своем развитии контрольные растения и характеризуются повышенной продуктивностью.
Похожие патенты RU2080780C1
Иллюстрации к изобретению RU 2 080 780 C1


Реферат патента 1997 года СПОСОБ КЛОНАЛЬНОГО МИКРОРАЗМНОЖЕНИЯ РАСТЕНИЙ
Использование: сельское хозяйство и биотехнология. Сущность изобретения: клональное микроразмножение заключается в том, что экспланты высаживают на питательную среду для получения регенератов, проводят их микрочеренкование и укоренение микрочеренков на питательной среде, содержащей в качестве источников углерода фруктозу или смесь фруктозы с сахарозой в количестве 10000-20000 мг/л среды, причем в смеси соотношение фруктозы к сахарозе 0,2-1:1 соответственно. 1 з.п. ф-лы, 3 табл.
Формула изобретения RU 2 080 780 C1
1. Способ клонального микроразмножения растений, включающий посадку экспланта на питательную среду для получения регенерантов, их микрочеренкование и укоренение микрочеренков на питательной среде, содержащей сахара в качестве источника углерода, отличающийся тем, что в качестве источника углерода в питательной среде для укоренения используют фруктозу или смесь фруктозы с сахарозой в количестве 10000 20000 мг/л среды. 2. Способ по п.1, отличающийся тем, что используют смесь фруктозы с сахарозой в соотношении 0,5 1 1 соответственно.
Мох сфагнум: описание, использование для комнатных растений. Где растет сфагнум?

- 27 Августа, 2018
- Зелень и травы
- Михаил
Наверное, практически каждому читателю, хотя бы иногда выбирающемуся в лес, доводилось видеть сфагнум – мох, покрывающий почву на сырых участках. Опытные люди стараются запомнить такие места, чтобы при необходимости прийти туда за ценным растением. Однако не все знают, как он выглядит и для чего нужен. Постараемся устранить этот пробел в образовании.
Что такое сфагнум?
В первую очередь стоит отметить, что сфагнум – это одна из разновидностей мха. Он довольно живуч, способен длительное время выдерживать как высокую, так и низкую влажность. Считается, что изначально он был водорослью, однако в результате изменения климата и уменьшения площади озер приспособился к обитанию в сырых местах.
Как он выглядит
Теперь стоит рассказать, как выглядит мох – на тот случай, если читатель решит запасти его впрок.
Внешне он весьма неприметен – тонкий зеленый стебелек, идущий от корня, слегка ветвящийся кверху. Покрыт крохотными листочками, обвивающими его по спирали. Интересная особенность: мох сфагнум корней не имеет. То, что неопытные сборщики считают корнем, на самом деле является отмершей частью. Ведь сфагнум – многолетнее растение. На зиму он замерзает, а весной продолжает расти. Причем растет исключительно верхняя часть – нижняя постепенно отмирает, перегнивает, превращается в торф.
Растет довольно плотно, преимущественно в сырых местах. Поэтому достаточно света для развития получает только верхняя часть. В нижней, находящейся в тени, а зачастую и в воде, хлорофилл постепенно разрушается. Из-за этого растение из зеленого превращается в белое. А подгнивающая часть имеет коричневый цвет.

Размножение мха сфагнума, как и у других мхов, происходит благодаря спорам. На стебле созревают половые клетки, в которых появляются споры. Когда они достаточно созревают, мешочек лопается, а вода и ветер разносят мельчайшие споры на большое расстояние.
Где растет
Наверняка многим читателям интересно, где растет мох сфагнум в России. Найти его можно в густых лесах, преимущественно в северных регионах страны. Излюбленное место обитания – болота, берега ручьев, небольших озер, рек со слабым течением.
В целом расти он может практически на любой поверхности – земля, глина, камень, даже железо и стекло! Главное, чтобы было достаточно влаги и хоть немного солнечного света. Очень редко можно увидеть его и в степях, опять же поблизости от источников влаги.
Сферы применения
Не все знают, что это удивительное растение используется в самых разных сферах деятельности человека: растениеводство, строительство, разведение домашних животных, даже медицина и косметология!

Определенные особенности мха сфагнума делают его поистине незаменимым.
Начать с того, что он легко пропускает воздух, при этом легко улавливая или отдавая влагу. Как утверждают специалисты, мох способен вобрать в себя влагу, объем которой в двадцать раз превышает его собственный! Настоящее чудо природы. Не менее важно, что он обладает антисептическими свойствами. Именно это делает его весьма популярным в экстремальной медицине.
Впрочем, чтобы не быть голословными, расскажем о его применении в разных сферах более подробно.
Использование в цветоводстве
Конечно, чаще всего используется мох сфагнум для комнатных растений. Здесь перечислить все способы применения практически невозможно. Расскажем хотя бы об основных.
Для начала – проращивание семян. Не нужно использовать увлажненную ткань, которую приходится смачивать в теплой и сухой квартире по 2-3 раза на дню. Просто заверните семена в клочок сфагнума, хорошенько полейте, уберите в место, где они не будут мешать, и забудьте на несколько дней. Сначала мох вберет избыток влаги в себя, так что семена точно не сгниют. А потом, по мере их высыхания, он будет отдавать влагу, увлажняя семена и обеспечивая подходящие условия для проращивания.
Этот же эффект можно использовать при уходе за взрослыми растениями. Просто уложите сфагнум толстым слоем на почву в горшке – и поливать цветок можно будет в несколько раз реже, чем обычно.
Также подобное решение позволяет решить проблему инфекционных и бактериологических заболеваний. Можете не сомневаться – растение, контактирующее с этим мхом, точно не заразится, а все благодаря все тем же антисептическим свойствам. Грибки и плесень также не доставят ни малейших проблем.

Заодно мох делает почву, где он растет, более мягкой, рыхлой. Конечно, это позитивно сказывается на процессе прорастания, укоренения и дальнейшего роста декоративных цветов и кустарников.
Наконец, его всегда можно измельчить и смешать с землей. Быстро перегнивая, он превращается в торф, питающий растение всеми необходимыми веществами. Так что мох сфагнум для комнатных растений является настоящим подарком, существенно облегчающим при этом жизнь цветоводам.
Сфагнум и медицина
Далеко не все знают, что во время войн многие солдаты и офицеры выжили после тяжелых ран именно благодаря мху. Обычного перевязочного материала не хватало, да и не всегда он оказывался под рукой. Если не было возможности продезинфицировать рану, на нее просто укладывался пучок мха, который обматывался поверх любой тканью – далеко не всегда стерильной. Сфагнум обеззараживал как рану, так и сам перевязочный материал. Процесс заживления шел куда быстрее, практически не встречалось случаев воспаления, загнивания раны. В годы Великой Отечественной войны даже создавались специальные отряды из пионеров, занимавшихся заготовкой этого ценного сырья. Многие тонны удивительного растения отправлялись на фронт, использовались вместо дефицитных лекарств и спасли немало людей от инвалидности и смерти.
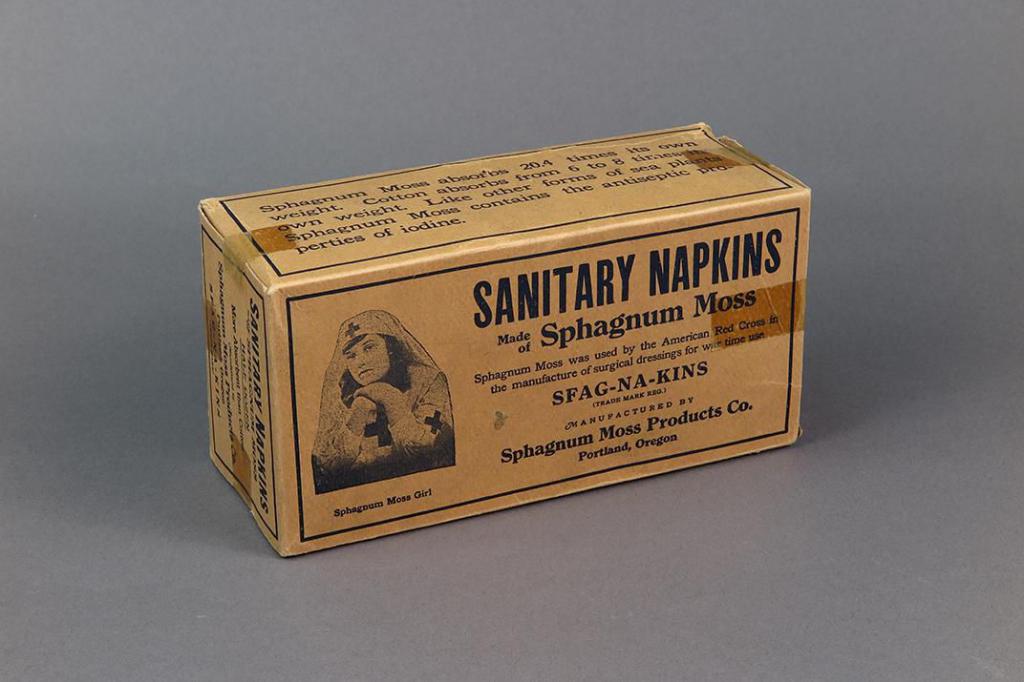
Используется он и сегодня. К примеру, положив в обувь небольшое количество мха, вы навсегда избавитесь от грибка стопы или ногтей. И это без покупки дорогостоящих препаратов, зачастую имеющих сомнительную эффективность и немало побочных эффектов.
Принимают и ванны со мхом. Для этого в три литра горячей воды добавляется 100 грамм сушеного сфагнума. Полчаса его настаивают, после чего фильтруют и добавляют в теплую ванну. Оптимальная схема – две процедуры в неделю, каждая по 20 минут. Такие ванны позволяют ослабить артрит, артроз, а также улучшить вывод токсинов из организма, усилить потоотделение, избавиться от избытка соли.
Заботимся об улитках
Хорошо знаком сфагнум и многим любителям сухопутных улиток. Причем он позволяет решить сразу целый комплекс проблем. И это при том, что вопроса, как использовать мох сфагнум для улиток, даже не возникает: достаточно положить пучок в террариум с достаточной влажностью, и можно забыть о нем.
Мох будет быстро расти, поддерживать оптимальный уровень влажности. Также сфагнум довольно привлекателен: насыщенно-зеленые стебли оживляют террариум, делают его более красивым.
Улитки довольно редко болеют инфекционными заболеваниями. Но если они живут в террариуме со мхом, то вероятность болезни полностью исключена – дополнительный плюс для любителей улиток.
Кроме того, мох может послужить прекрасным дополнением к рациону ваших питомцев. При подходящих условиях он быстро растет, и как бы быстро улитки его ни поедали, серьезного вреда они не причинят, не говоря уж про полное уничтожение своеобразного живого газона.
Заодно он позволяет следить за уровнем влажности, играя роль своеобразного индикатора. Если стебли зеленые – все в порядке. А вот если листья начинают желтеть, значит, воздух в террариуме очень сухой, стоит добавить немного воды, чтобы и мох, и улитки чувствовали себя достаточно комфортно.
Выращивание мха
Эта процедура настолько проста, что с нею легко справится даже маленький ребенок. В первую очередь нужно добыть где-то хотя бы небольшой пучок сфагнума. Сделать это можно в магазине, через интернет, а лучше всего – выбраться в лес и собрать небольшое количество растения в естественной среде обитания.
В последнем случае его стоит промыть. Процедура очень простая: замочите теплой водой (желательно из фильтра или отстоявшейся, чтобы удалить хлор) и оставьте на несколько часов. Время от времени подходите, переворачивайте его, аккуратно, чтобы не повредить стебли, тормошите стебли. За это время любой мусор, земля, песок, насекомые и черви окажутся на дне. Осталось только аккуратно извлечь растение, а загрязненную воду смыть.

После этого начинается выращивание мха сфагнума. Уложите его в подходящую емкость – прекрасно подойдет небольшой аквариум или даже простая трехлитровая банка. Добавьте небольшое количество воды и оставьте в теплом, солнечном месте. Мох не слишком боится избытка солнца, но в этом случае следует увеличить количество влаги в целях предотвращения пересыхания. Можно закупорить емкость, создав таким образом маленькую замкнутую экосистему. А можно просто время от времени доливать воду.
Проблем при выращивании наверняка не возникнет: мох будет выделять кислород на свету. Углекислый газ выделяется в темноте, а также в результате гниения нижней части. Солнечный свет и достаточное количество влаги довершают список всего необходимого для успешного развития растения.
Как заготавливать мох
Отправившись в лес, соберите достаточно мха. Желательно делать это поблизости от ручьев или на сильно увлажненной почве, в тени деревьев – это наиболее комфортные условия, а значит, и сфагнум будет высшего качества.

Собирать можно двумя способами. Во-первых, просто срывать и складывать в подходящий пакет или сумку вместе с “корнями”. В этом случае процесс сбора идет быстрее, да и торфяное удобрение, если оно вас интересует, сформируется быстрее. Но объем здорового, живого мха при этом сократится. Во-вторых, можно воспользоваться обычными ножницами, срезая верхний слой мха – только зеленый, оставляя белый на земле. Тогда даже в небольшой пакет поместится большое количество растения, которое будет хорошо расти.
Подготовка к хранению
Дальнейшие процедуры зависят от ваших целей. Вас интересует сухой сфагнум, используемый в медицинских целях? Тогда следует развесить его – на прочной нитке, шнуре или любым другим способом. В крайнем случае можно разложить его на газете, сложенной в несколько слоев, и оставить на солнце. Но при таком методе желательно сделать слой максимально тонким, регулярно перемешивать мох. Иначе снаружи он высохнет, образуя корку, а внутри останется влага, которая сделает длительное хранение невозможным – появится плесень или же сфагнум просто сгниет.

А вот если вам хотелось бы сохранить его живым как можно дольше, можно просто убрать мох в бумажный пакет и засунуть в морозильную камеру. Здесь он свободно пролежит несколько месяцев, а то и лет. Вытащив, положите его в теплое, влажное место. Через несколько часов он оттает, а спустя несколько дней – пойдет в рост. Но учтите: чем дольше сфагнум хранился замороженным, тем больше стеблей погибнет. Их стоит убрать, как только будет понятно, что они нежизнеспособны.
Заключение
На этом заканчиваем статью. Теперь вы знаете гораздо больше об удивительном мхе сфагнуме, его особенностях, сферах применения. А при необходимости легко сможете заготовить его разными способами и даже вырастить в домашних условиях.






